PERKEMBANGAN MODEL ATOM
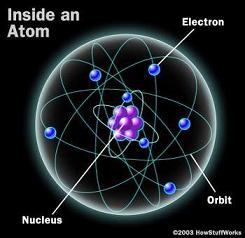 Penelitian-penelitian terbaru menyebabkan teori dan model atom semakin berkembang dan kebenarannya semakin nyata. Teori dan model atom dimulai dengan penelitian yang dilakukan oleh John Dalton yang selanjutnya dikembangkan oleh Joseph John Thompson, Ernest Rutherford, Niels Bohr dan teori atom menggunakan mekanika gelombang.
Penelitian-penelitian terbaru menyebabkan teori dan model atom semakin berkembang dan kebenarannya semakin nyata. Teori dan model atom dimulai dengan penelitian yang dilakukan oleh John Dalton yang selanjutnya dikembangkan oleh Joseph John Thompson, Ernest Rutherford, Niels Bohr dan teori atom menggunakan mekanika gelombang.
 Model atom John Dalton
Model atom John Dalton
 Model atom Joseph John Thompson
Model atom Joseph John Thompson
Rutherford berhasil menemukan bahwa inti atom bermuatan positif dan elektron berada diluar inti atom. Akan tetapi teori dan model atom yang dikemukakan oleh Rutherford juga masih mempunyai kelemahan yaitu teori ini tidak dapat menjelaskan fenomena kenapa elektron tidak dapat jatuh ke inti atom. Padahal menurut fisika klasik, partikel termasuk elektron yang mengorbit pada lintasannya akan melepas energi dalam bentuk radiasi sehingga elektron akan mengorbit secara spiral dan akhirnya jatuh ke iti atom.
 Model Atom Ernest Rutherford
Model Atom Ernest Rutherford
 Model Atom Niels Bohr
Model Atom Niels Bohr
 Model Atom Mekanika Quantum
Model Atom Mekanika Quantum
Constituents of the Atom Penelitian-penelitian terbaru menyebabkan teori dan model atom semakin berkembang dan kebenarannya semakin nyata. Teori dan model atom dimulai dengan penelitian yang dilakukan oleh John Dalton yang selanjutnya dikembangkan oleh Joseph John Thompson, Ernest Rutherford, Niels Bohr dan teori atom menggunakan mekanika gelombang.
Penelitian-penelitian terbaru menyebabkan teori dan model atom semakin berkembang dan kebenarannya semakin nyata. Teori dan model atom dimulai dengan penelitian yang dilakukan oleh John Dalton yang selanjutnya dikembangkan oleh Joseph John Thompson, Ernest Rutherford, Niels Bohr dan teori atom menggunakan mekanika gelombang.Model Atom John Dalton
Hukum kekekalan massa yang disampaikan oleh Lavoisier dan hukum perbandingan tetap yang dijelaskan oleh Proust mendasari John Dalton untuk mengemukakan teori dan model atomnya pada tahun 1803. John Dalton menjelaskan bahwa atom merupakan partikel terkecil unsur yang tidak dapat dibagi lagi, kekal dan tidak dapat dimusnahkan demikian juga tidak dapat diciptakan. Atom-atom dari unsur yang sama mempunyai bentuk yang sama dan tidak dapat diubah menjadi atom unsur lain. Model atom John Dalton
Model atom John Dalton Model Atom Joseph John Thompson
Joseph John Thompson merupakan penemu elektron. Thompson mencoba menjelaskan keberadaan elektron menggunakan teori dan model atomnya. Menurut Thompson, elektron tersebar secara merata di dalam atom yang dianggap sebagai suatu bola yang bermuatan positif. Model atom yang dikemukakan oleh Thompson sering disebut sebagai model roti kismis dengan roti sebagai atom yang bermuatan positif dan kismis sebagai elektron yang tersebar merata di seluruh bagian roti. Atom secara keseluruhan bersifat netral. Model atom Joseph John Thompson
Model atom Joseph John Thompson Model Atom Ernest Rutherford
Penelitian penembakan sinar alfa pada plat tipis emas membuat Rutherford dapat mengusulkan teori dan model atom untuk memperbaiki teori dan model atom Thompson. Menurut Rutherford, atom mempunyai inti yang bermuatan positif dan merupakan pusat massa atom dan elektron-elektron mengelilinginya.Rutherford berhasil menemukan bahwa inti atom bermuatan positif dan elektron berada diluar inti atom. Akan tetapi teori dan model atom yang dikemukakan oleh Rutherford juga masih mempunyai kelemahan yaitu teori ini tidak dapat menjelaskan fenomena kenapa elektron tidak dapat jatuh ke inti atom. Padahal menurut fisika klasik, partikel termasuk elektron yang mengorbit pada lintasannya akan melepas energi dalam bentuk radiasi sehingga elektron akan mengorbit secara spiral dan akhirnya jatuh ke iti atom.
 Model Atom Ernest Rutherford
Model Atom Ernest Rutherford Model Atom Niels Bohr
Niels Bohr selanjutnya menyempurnakan model atom yang dikemukakan oeh Rutherford. Penjelasan Bohr didasarkan pada penelitiannya tentang spektrum garis atom hidrogen. Beberapa hal yang dijelaskan oleh Bohr adalah- Elektron mengorbit pada tingkat energi tertentu yang disebut kulit
- Tiap elektron mempunyai energi tertentu yang cocok dengan tingkat energi kulit
- Dalam keadaan stasioner, elektron tidak melepas dan menyerap energi
- Elektron dapat berpindah posisi dari tingkat energi tinggi menuju tingkat energi rendah dan sebaliknya dengan menyerap dan melepas energi
 Model Atom Niels Bohr
Model Atom Niels Bohr Model Atom Mekanika Gelombang
Perkembangan model atom terbaru dikemukakan oleh model atom berdasarkan mekanika kuantum. Penjelasan ini berdasarkan tiga teori yaitu- Teori dualisme gelombang partikel elektron yang dikemukakan oleh de Broglie pada tahun 1924
- Azas ketidakpastian yang dikemukakan oeh Heisenberg pada tahun 1927
- Teori persamaan gelombang oleh Erwin Schrodinger pada tahun 1926
 Model Atom Mekanika Quantum
Model Atom Mekanika Quantum The simplest model of the atom is shown in the diagram below:

This is the layout of a lithium atom, with three protons, three electrons, and four neutrons. The protons and neutrons are, of course, found in the nucleus. They are called nucleons. The electrons are found in shells orbiting the nucleus.
Question 1
How many protons neutrons and electrons are there in the lithium atom?
Answer 1
There are 3 protons, 3 electrons, and 4 neutrons in a neutral lithium atom.
It is important to understand:
- The nucleus is very small compared to the atom, about 10 000 times smaller. The diameter of an atom is in the order of 10-10 m, whereas the diameter of the nucleus in the order of 10-15 m.
- The atom is a very dynamic entity. The diagram shows a stylised representation; the reality is that there is absolute bedlam at the atomic level.
| Property | Electron | Proton | Neutron |
| Charge | -1 e | +1 e | 0 |
| Mass | 9.11 × 10-31 kg | 1.67 × 10-27 kg | 1.67 × 10-27 kg |
| Relative Mass | 1/1836 | 1.0000 | 1.0004 |
- The electron and the proton have the same value of charge, but the signs are different. We also use a quantity for the charge called electronic charge unit, e. 1 e = 1.602 × 10-19 C.
- The neutron has a very slightly higher mass than the proton.
A carbon atom has 6 protons and 6 neutrons. Draw out the carbon atom in a similar way to the lithium atom in the diagram above.

Question 3
What is the total charge of a carbon nucleus?
(a) in electronic charge units
(b) in coulombs
Answer 3
| What is the total charge of a carbon nucleus? | |
| (a) in electronic charge units | (b) in coulombs |
| + 6e | + 6 ´ 1.6 ´ 10-19 = 9.6 ´ 10-19 C |
What is the total charge of the electrons?
(a) in electronic charge units
(b) in coulombs
Answer 4
6 electrons, therefore the charge is -6e
This is -6 × 1.6 × 10-19 C = 9.6 × 10-19 C
Atoms are neutral because the positive charge and the negative charge cancel out. If an electron is removed, the atom becomes positively charged and we call the charged atom an ion. If an electron is added, we get a negative ion. The protons never move.
The movement of electrons between atoms is at the heart of chemical reactions.
Different atoms are distinguished by their numbers of protons and neutrons. We write the symbols using the following notation:

- A is called the nucleon number, or the mass number. It is the total number of nucleons.
- Z is the proton number or the atomic number, which is the number of protons. The number of protons determines the element.
We can determine the number of neutrons simply by subtracting the proton number from the nucleon number. ( No of neutrons = A – Z) Atomic particles are always in whole numbers.
- Isotopes have the same numbers of protons, but different numbers of neutrons.
- Isotopes have the same physical and chemical properties.
- If the proton number is altered, the element changes.
- Some isotopes are radioactive, as the nuclei are unstable.
| Question 5 |
| ANSWER | ||||||||||

Carbon 14 is an unstable isotope. It decays so that one of the neutrons turns into a proton.
Question 6
Can you draw out the new atom? How many protons, neutrons and electrons does it have? What is it?
dikutip dari http://widayanto84.wordpress.com/2010/08/15/atom-2/
Tidak ada komentar:
Posting Komentar